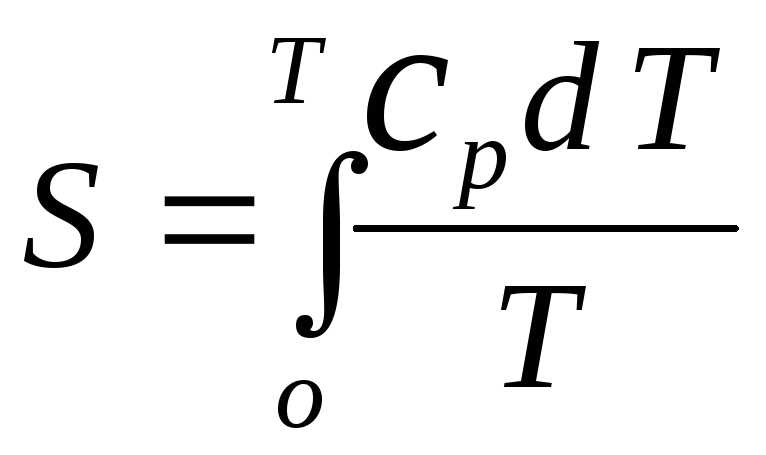
Планк был одним из величайших физиков своего времени, чьи исследования открыли перед нами новые горизонты понимания природы. Его работы стали основой для формулировки множества законов и постулатов, которые по сей день остаются важнейшими для физических наук. Один из таких законов — третий закон термодинамики — является краеугольным камнем в понимании тепловых процессов и энтропии.
Третий закон термодинамики был сформулирован Планком в начале ХХ века и был впервые изложен в его работе «Новые пути в физике«. Он гласит, что при абсолютном нуле температуры все молекулы вещества оказываются в наиболее упорядоченном состоянии, а их энтропия при этом достигает своей минимальной стандартной значения. Другими словами, постулат Планка утверждает, что энтропия любого вещества при исчезающе низкой температуре стремится к нулю.
Одной из особенностей третьего закона термодинамики является то, что его формулировка позволяет упорядоченно рассматривать состояния вещества даже когда температура близка к абсолютному нулю. Это позволяет исследовать свойства и поведение веществ при чрезвычайно низких температурах, а также разрабатывать новые технологии и материалы с уникальными свойствами.
Связь третьего закона термодинамики с постулатом Планка
Основная идея постулата Планка заключается в том, что энергия излучения может быть передана или поглощена только в виде квантов, то есть неделимых порций энергии, пропорциональных частоте этого излучения. Таким образом, энергия вещества осуществляет свои переходы между различными уровнями, сдвигаясь на определенные дискретные значения, что позволяет учесть статистическую природу энергетических состояний.
Третий закон термодинамики в свою очередь устанавливает связь между абсолютным температурным нулем и энтропией вещества. Он утверждает, что при абсолютном нуле температуры, когда все термодинамические процессы замирают, энтропия идеально структурированного кристаллического вещества достигает своего минимального значения.
Особенности идеально структурированного тела, обладающего повышенной степенью упорядоченности, в контексте третьего закона термодинамики и постулата Планка проявляются в том, что его энтропия оказывается равной нулю при абсолютном нуле. Это означает, что такие тела не проявляют никакой статистической хаотичности и обладают наименьшим уровнем разброса возможных энергетических состояний.
Применение третьего закона термодинамики и постулата Планка находит свое применение в различных научных и технических областях, где важно учитывать очень низкие температуры и энергетические процессы, связанные с ними. Например, в физике квантовых систем, при исследовании сверхпроводимости и создании новых материалов, которые работают при экстремально низких температурах.
Абсолютный температурный нуль и его роль в третьем законе термодинамики

Термодинамическая концепция абсолютного температурного нуля была сформулирована Лордом Кельвином во второй половине XIX века в результате его работ в области температурного измерения и термодинамики. Целью Кельвина было создание масштабной температурной шкалы, основанной на абсолютном нуле.
В своей работе, Лорд Кельвин показал, что при стремлении температуры к абсолютному нулю, энтропия вещества также стремится к нулю. Это связано с тем, что при абсолютном нуле вещество находится в состоянии минимального беспорядка или максимально упорядоченном состоянии – таком, где нет хаотичного движения молекул и атомов. Нулевое значение энтропии является одной из основных характеристик абсолютного температурного нуля.
Важность понятия абсолютного нуля связана с его ролью в третьем законе термодинамики. Этот закон говорит о невозможности достижения абсолютного нуля путем достижения температур, очень близких к нему. Также третий закон термодинамики устанавливает связь между энтропией и абсолютной температурой вещества. Возрастание энтропии при повышении температуры является одной из фундаментальных характеристик третьего закона.
Разнообразные области научных и технических исследований находят применение третьего закона термодинамики и понятия абсолютного температурного нуля. В материаловедении, этот закон помогает в понимании поведения различных материалов при экстремально низких температурах. В физике элементарных частиц, третий закон термодинамики используется для анализа условий приближения к абсолютному нулю и изучения свойств различных типов веществ.
Связь меры беспорядка и энтропии в третьем законе термодинамики
В третьем законе термодинамики и постулате Планка рассматривается вопрос о тепловом равновесии вещества при его абсолютном температурном нуле, который соответствует низшей тепловой энергии. Значение этого абсолютного нуля подразумевает идеально структурированное тело, в котором отсутствует всякий след беспорядка. Данное состояние достигается при скорости молекул, стремящейся к нулю.
Мера беспорядка в третьем законе термодинамики связана с понятием энтропии. Энтропия является мерой хаоса или беспорядка в системе. Чем выше энтропия, тем больше беспорядка в системе, и наоборот, чем меньше энтропия, тем более упорядочена система. В третьем законе термодинамики отсутствие беспорядка достигается при абсолютном нулевом значении энтропии.
Термодинамическая энтропия связана с раскрытием значимости постулатов Планка и третьего закона. Постулат Планка формулирует связь между энергией основного состояния и квантовым числом, которое определяет энергетическую структуру молекул. Таким образом, когда температура молекул приближается к абсолютному нулю, энергия основного состояния становится статистической и достигает минимального значения. Появляется идеально кристаллическое состояние вещества, где беспорядка практически нет.
Используя меру беспорядка и энтропию, можно оценить степень упорядоченности системы при различных значениях температуры. При приближении температуры к абсолютному нулю, мера беспорядка в системе стремится к нулю, а значит, энтропия конечная. Как следствие, третий закон термодинамики позволяет определить максимальное значение энтропии при абсолютном температурном нуле.
Понимание связи между мерой беспорядка и энтропией является важным в научных и технических областях, где третий закон термодинамики и постулат Планка применяются. Например, в материаловедении и физике особое внимание уделяется характеристикам кристаллической структуры веществ, так как они напрямую связаны с энтропией и мерой беспорядка. Понижение температуры при изготовлении материалов может влиять на их структуру и свойства.
| Термин | Значение |
| Беспорядок | Отсутствие упорядоченной структуры в системе |
| Энтропия | Мера хаоса и беспорядка в системе |
| Постулат Планка | Связь энергии основного состояния с квантовым числом |
| Третий закон термодинамики | Описание состояния при абсолютном нуле температуры |
Особенности идеально структурированного тела в контексте третьего закона термодинамики
Одной из особенностей такого тела является нулевая энтропия при абсолютном нуле температуры. В силу постулатов Планка и Нернста, при стремлении температуры к абсолютному нулю, энтропия системы также стремится к нулю. Данное свойство позволяет оценить степень «чистоты» структуры данного тела.
В таком идеальном теле, все молекулы находятся в максимально упорядоченном состоянии, в отсутствие какого-либо беспорядка. Таким образом, первое следствие из третьего закона термодинамики заключается в том, что при достижении температуры близкой к абсолютному нулю, все системы стремятся к такому идеально структурированному состоянию.
Однако, в реальной физической практике достижение абсолютного нуля температуры невозможно, поэтому идеально структурированное тело является лишь абстракцией. Тем не менее, изучение его свойств и особенностей позволяет лучше понять законы и принципы термодинамики.
Абсолютно структурированное тело обладает также особенностью неравномерного распределения зарядов и электронов. Вблизи абсолютного нуля температуры, распределение электрических зарядов становится таким, что они сосредоточены в максимальной близости друг к другу. Это свойство имеет важное значение в электротехнике и разработке микроэлектронных компонентов.
Особенности кристаллической структуры веществ и их связь с третьим законом термодинамики
Изначально, в начале процесса изучения третьего закона термодинамики, появился постулат Нернста, который гласит, что при абсолютном нуле температуры абсолютное значение энтропии любого вещества должно быть равно нулю. Однако, с развитием научных технологий и углублением исследований, было установлено, что не все типы кристаллических веществ достигают полного равновесия при абсолютном нуле.
Кристаллические вещества и совершенный порядок

Одной из особенностей идеально структурированного тела является полный порядок и отсутствие беспорядка. В идеальном случае, при достижении абсолютного нуля температуры, кристаллические вещества приходят в состояние абсолютного равновесия. Это означает, что все атомы или молекулы находятся в строго определенных позициях, образуя регулярную и упорядоченную структуру.
Однако, на практике не все вещества способны достичь такого идеально структурированного состояния даже при абсолютном нуле температуры. Некоторые кристаллические материалы могут содержать дефекты, такие как вакансии, дислокации или точечные дефекты, которые приводят к нарушениям их идеальной структуры. Поэтому, при абсолютном нуле, энтропия таких веществ не достигает нуля, и они не находятся в полном равновесии.
Связь между энтропией и беспорядком

В третьем законе термодинамики особое внимание уделяется связи между энтропией и беспорядком. Чем ближе температура к абсолютному нулю, тем меньше энтропия и беспорядок в кристаллических веществах. Именно поэтому абсолютный температурный нуль служит важным ориентиром в третьем законе термодинамики.
Таким образом, третий закон термодинамики и постулат Планка позволяют лучше понять особенности кристаллической структуры веществ и ее связь с энтропией. Их применение находит широкое применение в научных и технических областях, где изучается поведение и свойства веществ при экстремально низких температурах и в условиях строгого равновесия.
Энергия заряда и ее связь с абсолютным температурным нулем
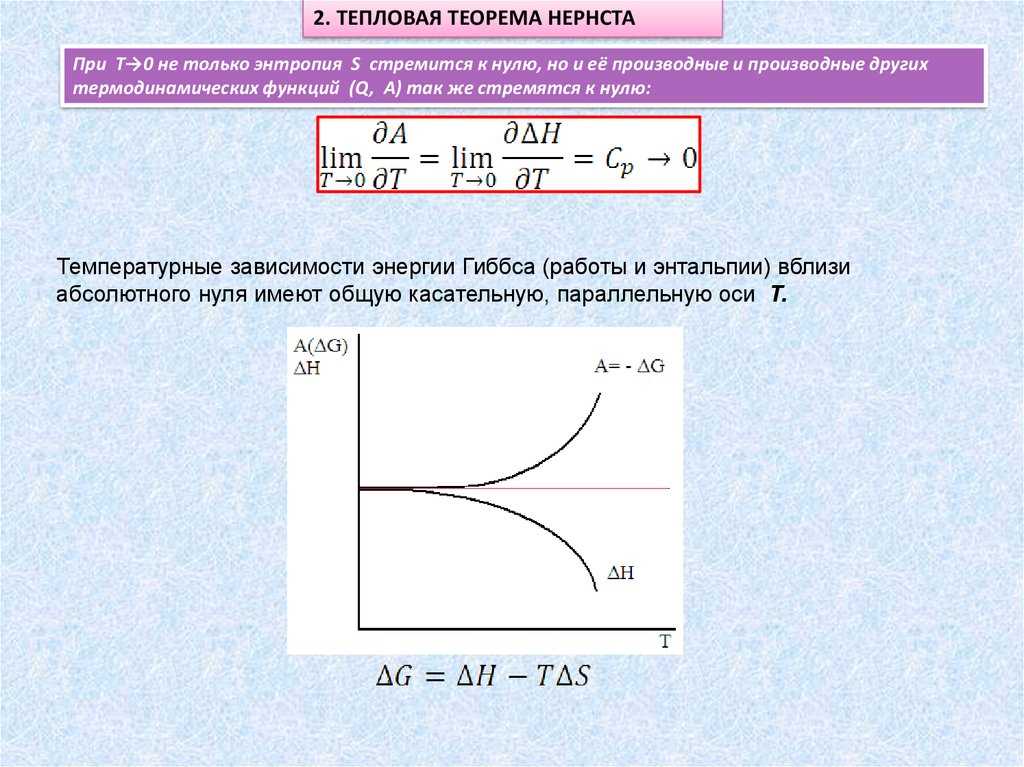
Абсолютный температурный нуль, обозначаемый символом ЗТН, является нижним пределом измерения температуры и равен -273,15°C или 0 K. Второй закон термодинамики утверждает, что невозможно достичь абсолютного нуля, однако его значение играет важную роль в третьем законе термодинамики и связано с энтропией.
Энтропия можно рассматривать как меру беспорядка или статистической неопределенности системы. В контексте третьего закона термодинамики и постулата Планка, энтропия при абсолютном температурном нуле равна нулю. Это означает, что вблизи ЗТН кристаллическая решетка идеально структурированного тела находится в состоянии абсолютного порядка.
Таким образом, скорость беспорядка, то есть скорость увеличения энтропии, при приближении к абсолютному температурному нулю стремится к нулю. Согласно постулату Планка, при этой температуре достигается минимальный уровень энергетического беспорядка и максимальная степень порядка в кристаллической решетке.

0 Комментариев